除了蛋白质的经典功能(例如充当生物催化剂或结合partner)之外,还需要考虑蛋白质的构象状态及其在刺激下的重塑。经历全面构象重塑的蛋白质的一个突出例子是转谷氨酰胺酶 2 (TGase 2),其不同的构象状态与特定功能密切相关。它参与各种病理生理过程,包括纤维化和癌症,这推动了治疗诊断剂的开发,特别是基于针对转酰胺酶活性的抑制剂。在这种情况下,此类抑制剂控制 TGase 2 构象动力学的能力成为一个重要参数,所以亟需评估这种特性的方法。本文描述了 switchSENSE® 原理的应用,用于检测由三种不可逆结合的 Nε -丙烯酰赖氨酸哌嗪引起的构象变化,这三种不可逆结合的 N" -丙烯酰赖氨酸哌嗪是 TGase 2 的合适放射性示踪剂候选物。switchSENSE® 技术基于由交变电场驱动的 DNA 纳米杆。这些杠杆的一端固定在金电极上,而杠杆的另一端则与 TGase 2 共价结合。通过一种新的计算方法来描述由此产生的杠杆运动,以量化刺激的构象 TGase 2 变化的程度。此外,作为一种补充的生物物理方法,在类似条件下进行了天然聚丙烯酰胺凝胶电泳以验证结果。这两种方法都证明了 三种研究的 Nε -丙烯酰赖氨酸哌嗪的结合引起了TGase 2 的构象平衡发生了不可逆转变。
蛋白质是构象动态分子,即使在其天然状态下也会经历一系列构象 [1,2]。因此,人们利用构象自由能图景制定了一个热力学概念,描述构象亚态和蛋白质的波动 [2–4]。从生化过程来看,蛋白质构象集合的重塑是细胞信号传导的核心方面 [5]。它也可以被视为一种离散信号传导[6]。构象灵活性是蛋白质的固有特性。然而,运动的种类和程度可能有所不同,从键振动和侧链旋转到域的集体运动 [3,7]。关于后一种蛋白质运动,已知经历显著构象重塑的蛋白质是转谷氨酰胺酶 2 (TGase 2)。TGase 2 是一种酶,它通过将蛋白质结合的谷氨酰胺残基的酰基转移到一级胺(转酰胺酶活性),包括蛋白质结合的赖氨酸残基和低分子量的生物胺和多胺,来催化 Ca2+ 依赖性的蛋白质翻译后修饰 [8,9]。除了这种酶功能外,TGase 2 还具有其他酶和非酶功能。例如,TGase 2 结合和水解 GTP 并充当二聚 Gh 蛋白的 Gαh 亚基 [10–12]。在此背景下,Ca2+和GDP/GTP分别作为GTP结合功能和转酰胺酶活性的变构调节剂。此外,这些分子的结合伴随着TGase 2的构象重塑[10,13]。
TGase 2 是一种单体蛋白,由 687 个氨基酸组成,摩尔质量为 77 kDa [14]。TGase 2 的结构由四个不同的结构域组成。N 端 β 夹层(氨基酸残基 1-139)后面是 α/β 催化核心(氨基酸残基 140-454),其中包含转酰胺酶活性的催化三联体(Cys-277、His-335 和 Asp-358)。该结构由两个连续的 β 桶(氨基酸残基 479-585 和 586-687)完成。核苷酸结合(GDP、GTP、ATP)TGase 2 的 X 射线晶体结构揭示了 TGase 2 的紧凑(“封闭”)构象,其中 C 端 β 桶状结构折叠在 α/β 催化域前方(图 1A)[15,16]。与核苷酸结合的 TGase 2 相反,与不可逆结合肽抑制剂复合的 TGase 2 的 X 射线晶体结构揭示了细长的(“开放”)构象,其中 C 端 β 桶状结构不会遮挡进入转酰胺酶活性位点的通道(图 1B)[17]。α/β 催化核心与后续 β 桶状结构之间的柔性环(氨基酸残基 455–478)被认为是铰链区,允许 β 桶状结构移动 [15,17–19]。尽管抑制剂结合的 TGase 2 的结晶是在 Ca2+ 存在下进行的,因为 Ca2+ 是结合转酰胺酶定向化合物所必需的,但在抑制剂结合结构中未发现 Ca2+。因此,人们通常假设但推测“开放”构象是否是 Ca2+ 激活构象(或它们的集合)的代表性快照。在这种情况下,在解析 TGase 2 的第一个晶体结构之前,Carlo Bergamini 团队根据因子 XIIIa(TGase 家族的另一个成员)的同源模型进行了小角度辐射散射(SAXS 和 SANS)和蒙特卡罗实验。他们的结果表明,Ca2+ 的结合导致 C 端 β 桶的最小旋转,从而揭示了活性位点 [18,19]。同样,Di Venere 等人 根据光谱技术(CD、稳态和动态荧光)的结果,认为 Ca2+ 会诱导 TGase 2 结构的“开放”[20]。除了结晶、辐射散射、光谱和模拟方法外,还通过其他各种方法评估了 TGase 2 的构象变化[21]。这些方法包括电泳法,例如天然(非变性)凝胶电泳[17,22–27]、动力学毛细管电泳[28,29]和通过质谱监测的氢/氘交换(HDX-MS)[30]。虽然这些方法主要侧重于研究分离的 TGase 2 和各种配体的构象效应,但基于 Förster 共振能量转移的分析被用于研究活细胞中 TGase 2 的构象动力学[31,32]。所有提及的研究都证明,TGase 2 在核苷酸结合形式和 Ca2+ 激活或抑制剂结合形式之间发生了显著的构象重塑。
由于细胞内 GTP(≈100–150 µM)和 Ca2+(≈0.1 µM)浓度,TGase 2 在细胞内采用与“闭合”构象相关的构象,因此在生理条件下被认为基本上不具有转酰胺酶活性 [31–33]。在与 Ca2+ 稳态丧失相关的生理应激情况下,会发生向“开放”构象的构象重塑;事实上,Ca2+ 水平会升高,蛋白质会变得具有转酰胺酶活性 [31,32]。而转酰胺酶TGase 2 主要在细胞外环境中发挥 TGase 活性,并被认为与纤维化 [34–37]和乳糜泻 [38,39] 等病理生理过程有关。各种肿瘤实体的特征是 TGase 2 表达增加,这与不良预后有关 [40]。此外,TGase 2 似乎对癌症干细胞的存活至关重要 [41–44]。这使得 TGase 2 成为治疗诊断方法中一个有吸引力的肿瘤相关靶点,主要关注转酰胺酶活性导向的共价抑制剂,其诱导 TGase 2 构象重塑为“开放”构象。通过这些药物的作用,转酰胺酶活性受到抑制,GTP 的结合受到阻断 [45–47]。此外,有人认为这种构象重塑本身具有细胞毒性 [48,49]。因此,评估新化合物对 TGase 2 构象动力学的影响非常重要。

一种用于此类评估的新兴技术是 switchSENSE®,如图 2 所示。这种动态方法基于金电极上的电驱动 DNA 杠杆与高度时间分辨的荧光检测相结合。除了多聚阴离子性质外,杠杆理想情况下还应具有尽可能大的机械刚度。因此,在大多数情况下,双链 (ds) DNA [50–52],在某些情况下,特别是当需要驱动较重的蛋白质时,甚至更硬的 DNA 折纸结构也被用作杠杆 [53,54]。为了在表面上制备此类致动器,金电极用硫醇修饰的单链 (ss) DNA 寡核苷酸进行功能化。这些 ssDNA 链中的每一条都在其硫醇部分的对面末端带有荧光团。在本研究中,第一步,通过表面结合寡核苷酸与互补 ssDNA 链杂交形成 48 个碱基对长的 dsDNA 杆(图 2A)。然后,通过电触发时间相关单光子计数 (E-TCSPC) 记录所得的 16.3 nm 长的裸 dsDNA 杆的运动。当分别通过向电极施加正或负电位使杆被电极吸引或排斥时,这种动态模式能够以 100 ns 的时间分辨率检测荧光强度。荧光强度与荧光团与金表面的距离相关。由于能量转移,随着荧光团与金表面之间距离的减小,荧光不断猝灭。 [55]
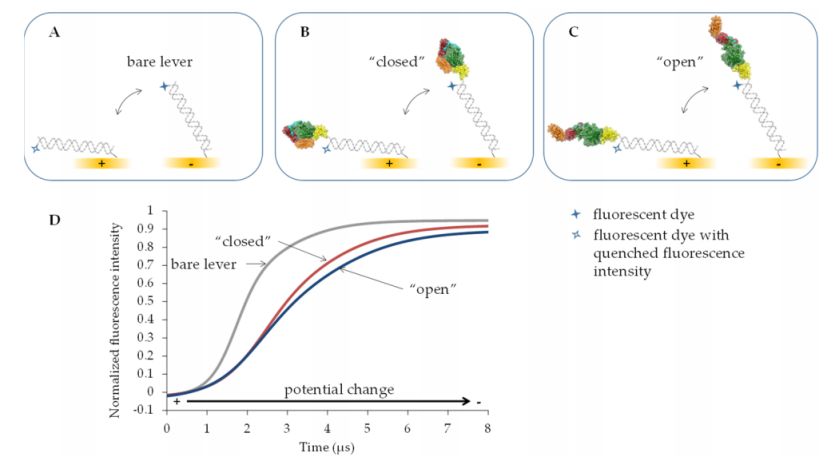

在获取裸 dsDNA 杠杆运动动力学的参考值后,随后进行脱杂化,为 TGase 2-ssDNA 结合物提供带有 ssDNA 的电极表面。然后通过将电位从正值切换到负值来研究其远端共价结合有 TGase 2 的所得双链杠杆(图 2B、C)。与裸 dsDNA 杠杆的运动相比,TGase 2-dsDNA 结合物的运动速度减慢,因为结合物的流体动力学流动阻力较大。后者改变的程度取决于附着的 TGase 2 的实际构象。为了量化由不同效应物引起的 TGase 2 构象变化的程度,本文使用了荧光强度增加(TGase 2-dsDNA 结合物向上运动)的动力学中的最大斜率(图 2D)。“闭合” TGase 2 构象表现出大约 10 nm 的整体延伸,而“开放”构象则约为 15 nm(图 1A、B)。因此,“闭合”构象预计会有更快的动态。在 switchSENSE® 技术的所谓静态模式下,恒定电场使 DNA 杠杆相对于金电极保持直立 [56]。在这些条件下,可以通过荧光近距离传感检测分析物的结合。也就是说,分子相互作用以及靠近荧光团的构象变化可能会改变其局部环境,因此,荧光信号可以增强或减弱。在本研究中,我们表征了一种最近描述的(1,图 1C)和两种新的 N" -丙烯酰赖氨酸衍生的 TGase 2 不可逆抑制剂(2 和 3,图 1C),以及它们对构象动力学的影响,使用 switchSENSE®。Staffler 等人 [57] 最近证明了该方法对 TGase 2 的适用性,主要侧重于评估 GTP 类似物的结合动力学。在此,研究了两种不同的 TGase 2 与寡核苷酸结合策略(非定向和 His 标签定向胺结合)。此外,评估了 DMSO(1-3 储备溶液的溶剂)和 Ca2+(转酰胺酶活性 TGase 2 所必需的)对裸 dsDNA 杠杆运动的影响,以发现溶剂组成,避免了与杠杆相互作用而产生的伪影。关于动态模式下的数据分析,引入了一种新颖的计算方法,该方法包括将双逻辑函数拟合到时间分辨的归一化荧光强度。
对于 hTGase 2(以 His6 标记蛋白的形式购买)与 ssDNA 的结合,使用市售偶联试剂盒应用了两种不同的共价结合策略。第一种策略使用用 NHS 酯修饰的 ssDNA 通过其 N 端或赖氨酸侧链标记 hTGase 2(以下称为“非定向标记”)。对于第二种策略,采用 DNA 模板化蛋白质结合方法,使用 trisNTA 功能化的引导 DNA 将 NHS 功能化的 ssDNA 引导至 hTGase 2 的 N 端附近(以下称为“His 标签定向标记”)[62]。第二种策略旨在实现位点选择性蛋白质结合,而非通过非定向标记随机结合到任何可用的氨基上。通过这两种策略,hTGase 2 成功与 ssDNA 偶联,并纯化了蛋白质-DNA 复合物(。然而,非定向标记提供的 ssDNA-hTGase 2 结合物的产量高于 His-tag 定向标记(基于所用的 hTGase 2 量,纯化结合物的产量分别为 27% 和 11%)。值得注意的是,这两种标记类型都使 ssDNA-hTGase 2 结合物与 ssDNA 功能化芯片的杂交效率相似。杂交后,在两种情况下,在动态模式下操作期间,hTGase 2 结合的 dsDNA 杆与裸 dsDNA 杆的时间依赖性荧光信号有明显差异(图 2),即观察到附着蛋白质的 DNA 杆向上运动较慢。
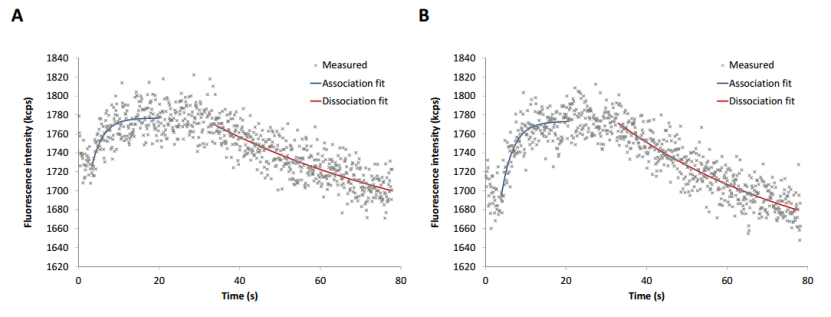
为了评估两种标记类型的 GTPγS 结合动力学和 hTGase 2 伴随的构象变化,首先应用静态模式。为此,将 20 nM GTPγS 冲洗到电极上。在 GTPγS 存在下,荧光信号增加(结合,图 3);通过去除核苷酸,荧光信号降低(解离,图 3)。两个 hTGase 2-dsDNA 杠杆的曲线模式相似。然而,与非定向标记(图 3A)相比,His 标签定向标记(图 3B)提供了略高的荧光增加,同时伴有更高的信噪比。根据方程 (5) 和 (8) 进行回归分析(参见材料和方法)给出了结合和解离的速率常数。解离常数 Kd 总结在表 1 中。两种标记类型都产生了可比的动力学参数,Kd 值与 Staffler 等人在类似条件下获得的值一致 [57]。

此外,GTPγS 和 Ca2+ 与 hTGase 2 的结合应在动态模式下影响 hTGase 2-dsDNA 杠杆的向上运动。与 DNA 杠杆结合的蛋白质的尺寸估计通常基于计算相应的流体动力学直径,同时考虑蛋白质-DNA 结合物的切换运动和裸露的 DNA 杠杆的切换运动 [56]。然而,一方面,已知 TGase 2 结构是非球形的,另一方面,一组构象可能对测量的时间分辨荧光强度有贡献。因此,所谓的“棒棒糖模型”可能不是最有利于构象变化分析的。特别是对于 TGase 2,Staffler 等人 [57] 报告了他们从 switchSENSE® 得出的流体动力学直径与从晶体结构和动态光散射测量计算出的值之间存在明显差异。因此,开发了一种新的计算方法,包括将双逻辑函数拟合到时间分辨的归一化荧光强度。在此基础上,计算了拟合函数拐点处的最大斜率。该斜率的倒数应该与结合蛋白或蛋白-抑制剂复合物的结构变化引起的摩擦几乎成比例。这意味着 DNA 杆向上运动的速度越慢,倒数斜率就越高,摩擦力也就越大。在这种情况下,我们假设结合酶的流体动力学摩擦取决于其构象(图 2)。预计“开放”构象(图 1B)将比“封闭”构象(图 1A)产生更高的摩擦力。因此,时间依赖性的归一化荧光强度应显示更大的最大斜率,因此“封闭”构象的倒数斜率应小于“开放”构象(图 2D)。此外,事实证明,将一系列要比较的条件中的所有倒数斜率除以在相关连续之前直接测量的裸 DNA 杆的倒数斜率是有利的。然后使用以这种方式获得的相对倒斜率来量化酶的构象变化。Knezevic 等人 [50] 描述了一种类似的方法,即计算由快速傅里叶变换滤波器平滑的时间依赖性荧光曲线的一阶导数的最大值。尽管如此,拟合双逻辑函数来确定拐点还是有一些优势的。此处使用的双逻辑函数是适用于“S”形曲线的 S 形函数。该函数由两个逻辑函数的总和形成 [63]。借助双逻辑函数,可以充分描述归一化荧光强度的完整、通常不对称的时间分辨曲线。特别是,可以可靠地近似拐点周围的区域。从得到的显式最佳拟合函数中,可以获得任意阶的导数函数(相对于时间导出),以确定具有最大斜率的拐点。
事实上,在存在 GTPγS 的情况下,相对逆斜率明显小于纯缓冲液中不含 GTPγS 的情况(图 4),因为已知 GTP 类似物会使 TGase 2 的构象动力学向“闭合”构象转变(图 1A)。随后去除 GTPγS 并暴露于 Ca2+ 会增加相对逆斜率,甚至超过在没有任何效应物的情况下 hTGase 2-dsDNA 杠杆的值(图 4;有关动力学,请参阅补充材料中的图 S2)。这反过来又与最近的数据一致,表明 Ca2+ 的结合有利于 TGase 2 形成相当细长的构象 [18–20,29,32],这应该会增加 DNA 杠杆的摩擦力(图 2B)。在这种情况下,TGase 2 的构象重塑可能是各种中间构象的动态平衡,这有助于 hTGase 2-dsDNA 杠杆的摩擦力。因此,在没有任何效应器的情况下,观察到的摩擦力大概是中等强度的。
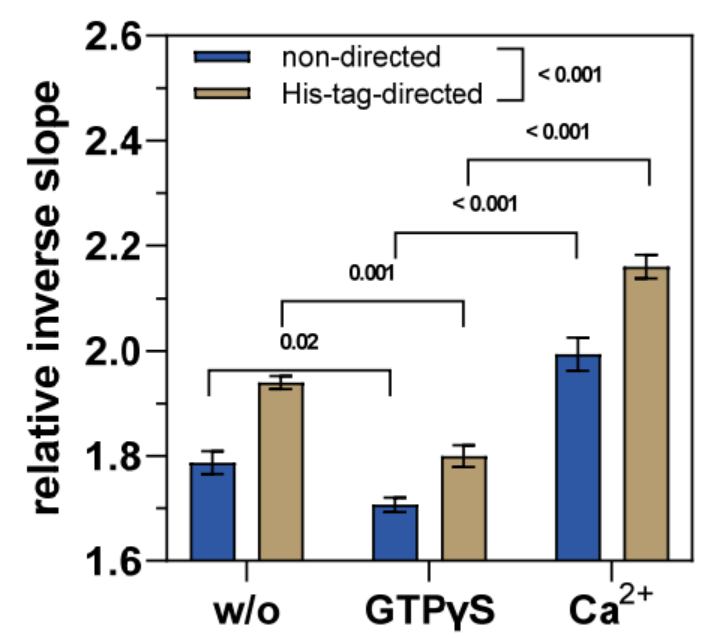

通过比较不同标记类型的结果,可以明显看出 His 标签引导标记产生的相对倒数斜率值明显更高(p < 0.001)(图 4)。这与在静态模式下评估的 GTPγS 结合动力学的结果一致(图 3)。因此,TGase 2 与 ssDNA 的位点选择性偶联(此处通过 His 标签引导 DNA)对 switchSENSE® 两种测量模式的数据质量都有积极影响,Staffler 等人最近也提出了这一建议 [57]。特别是对于 TGase 2,靠近 N 端的功能化是有利的,因为在用 GTP 类似物和 Ca2+ 刺激时,N 端 β 夹层较少参与构象重塑。但是,如上所述,His 标签引导标记的主要缺点是制备结合物期间产量低。因此,我们决定利用非定向标记获得的 hTGase 2-ssDNA 进行抑制剂 1-3 的构象影响实验。
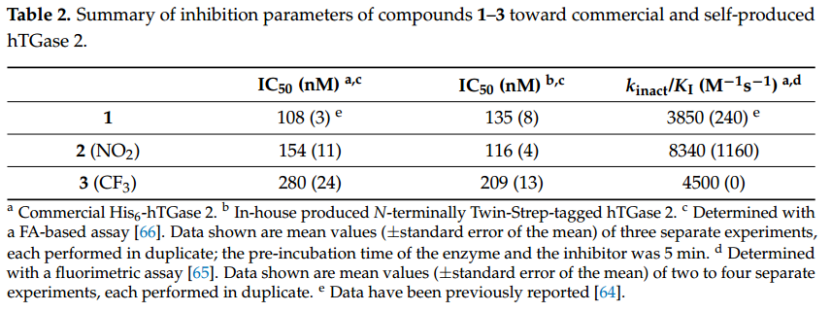
在分析抑制剂 1–3 对 TGase 2 构象动力学的影响之前,必须评估它们的抑制效力。虽然之前已显示化合物 1 具有出色的抑制效力 [64],但化合物 2 和 3 代表新化合物。使用荧光测定法测定 2 和 3 的动力学抑制效力 [65],结果显示 kinact/KI 值分别为 8340 M−1 s −1 和 4500 M−1 s −1 (表 2)。此外,在蛋白质和抑制剂预孵育 5 分钟后,用荧光各向异性 (FA) 分析法测定了抑制转酰胺酶活性的 IC50 值(2 和 3 分别为 154 和 280 nM,表 2)[64,66]。对于 SDS-PAGE 和天然 (GTP-)PAGE 实验,我们使用了自制的 Twin-Strep 标记的 hTGase 2,该酶被化合物 1-3 抑制,其 IC50 值在市售的 His 标记的 hTGase 2 的范围内(表 2,补充材料中的图 S3)
由于溶解度有限,抑制剂 1–3 的储备溶液通常在 DMSO 中制备,因此用于生化和生物测定的最终 DMSO 浓度在 0.1% 至 5% 之间。为了确定 DMSO 的潜在干扰,我们使用不同的溶剂成分评估了裸露 DNA 杆的向上运动(图 5)。虽然施加浓度为 1 mM 的 Ca2+ 不会改变时间依赖性荧光曲线的形状,但与纯水条件相比,1% DMSO 会导致曲线左移(图 5A)。幸运的是,当 DMSO 浓度降低到 0.1% 时,曲线的形状与水条件下的形状基本相同(图 5B)。因此,对于所有使用抑制剂 1–3 的 switchSENSE® 实验,最终 DMSO 浓度均设置为 0.1%。目前无法给出观察到 DMSO 影响的原因,但结果强调了仔细评估溶剂成分以避免测量伪影的必要性。

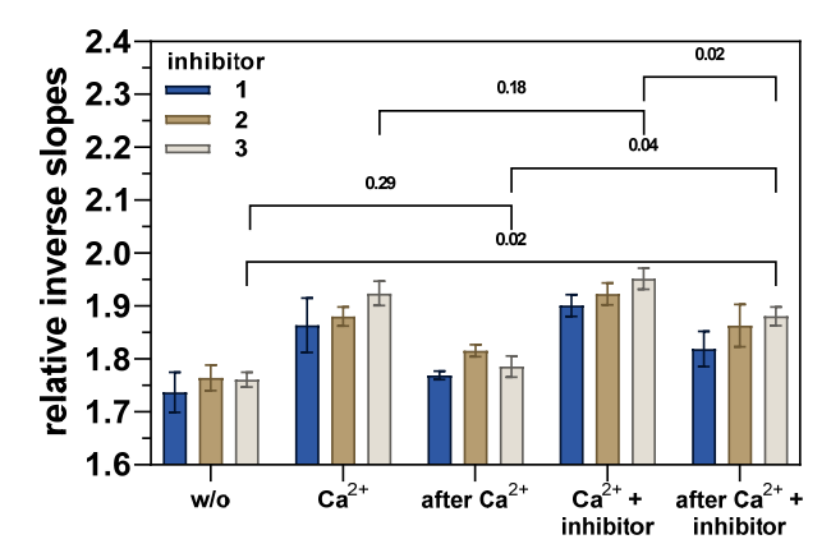
在验证了它们的抑制活性并找到了合适的溶剂组成后,评估了化合物 1-3 对 hTGase 2 的构象影响。为此,应用了以下处理顺序。(图 6 中使用的所得溶剂组成和/或 hTGase 2-dsDNA 杆的状态的符号用引号给出。)
1. 纯 TE40 缓冲液(“w/o”);
2. 含 1 mM Ca2+ 的 TE40(“Ca2+”);
3. 纯 TE40 缓冲液(去除 Ca2+;“Ca2+ 之后”);
4. 含 1 mM Ca2+ 和 10 µM 抑制剂的 TE40(“Ca2++ 抑制剂”);
5. 纯 TE40(去除 Ca2+ 和抑制剂;“Ca2++ 抑制剂之后”)。
图 6 显示了相对倒数斜率对 hTGase 2-dsDNA 杠杆向上运动的影响。如前所述(图 4),添加 Ca2+ 会增加摩擦力,因此,hTGase 2-dsDNA 杠杆的时间依赖性归一化荧光强度曲线中的相对倒数斜率也会增加,在去除 Ca2+ 后,该曲线几乎与添加 Ca2+ 之前相同(差异不具有统计学意义,图 6 和 S4)。同时添加 Ca2+ 和抑制剂似乎会使摩擦力增加到比单独添加 Ca2+ 更高的值(但这种差异对于所有抑制剂而言都不具有统计学意义,补充材料中的图 6 和 S4)。对于抑制剂 3,随后去除 Ca2+(“Ca2+ + 抑制剂之后”)会使摩擦力降低到与单独添加 Ca2+(“Ca2+”)相似的水平,但与“w/o”和“Ca2+ 之后”相比仍显着更高(图 6)。对于抑制剂 1 和 2,这种趋势相似;然而,应该注意的是,“Ca2++ 抑制剂后”与“w/o”和“Ca2+ 后”的差异中只有部分具有统计学意义(补充材料中的图 S4)。因此,数据可能表明这三种抑制剂在不可逆结合后将 hTGase 2 的构象平衡转变为更伸展的构象。Staffler 等人 [52] 最近使用 switchSENSE® 对肽类不可逆抑制剂 Z-DON-Val-Pro-Leu-OMe(“Z-DON”)获得了类似的结果。面对不同条件之间相对逆斜率的轻微变化以及随着治疗周期的增加电极的某些老化效应,有必要使用互补方法来可视化由于配体的共价或非共价结合而导致的 hTGase 2 的构象变化。


heliX+分子互作分析系统采用switchSENSE®技术,通过共价偶联或标签捕获方式将感兴趣的分 子(配体)固定在heliX®芯片上,结合标准的自动化 工作流程为分子互作提供高效解决方案。
同腾睿杰(上海)生物科技有限公司作为Dynamic Biosensors中国总代理商,为您提供优质的售前售后服务。
联系电话:021-50826962
联系邮箱:sales@ttbiotech.com




