对于药物筛选和多样性而言,肿瘤球介于单层培养的癌细胞和体内肿瘤之间,具有中等复杂度。肿瘤球体能够提高临床前研究数据的可靠性,并减少动物实验的需求,能以更短的实验周期确保实验结果的有效性。在本研究中,我们证明了使用 C.BIRD 培养方法可改善肿瘤球体的生长和细胞健康维持。我们的结果表明,C.BIRD 缩短了肿瘤球体的形成时间,并延长了药物筛选材料制备期间细胞的生长时间。
球体培养是一种体外三维细胞培养系统,它能提供细胞间以及细胞与细胞外基质(ECM)的相互作用网络,通过信号传导来维持细胞表型。它突破了在体外重现体内微环境的限制,正逐渐成为药物开发(包括药物筛选和癌症研究)的强大工具。球体培养能够模拟实体瘤中药物、营养物质、氧气和代谢物的扩散受限分布,而二维单层培养则无法做到这一点。球体培养架起了从传统二维培养到体内动物模型之间的信息桥梁,是制药和生物领域中可靠且广泛使用的方法。
尽管球体培养适合高通量筛选,并且可以在多孔板中进行规模放大,但在生成高质量球体方面仍存在局限性。我们在此展示了利用 C.BIRD 微生物反应器(图 1A)进行大量球体培养的创新培养方法。C.BIRD 由一个自主控制单元和一个带有 24 或 96 个流体通道的 C.BIRD 盖子组成(图 1B)。在本研究中,我们使用超低附着(ULA)圆底板对人结肠癌细胞系 HCT116 进行球体形成分析(图 1C)。将培养板转移到 C.BIRD 设备后,盖子的气动连接提供了低剪切力可调混合,以实现培养均匀化(图 1D)。通过使用这种特定的培养系统,我们证明了与静态培养形成的球体相比,球体形成和细胞健康维持有了显著改善。我们的新技术为优化球体培养环境提供了思路,并克服了生成高质量球体的障碍。
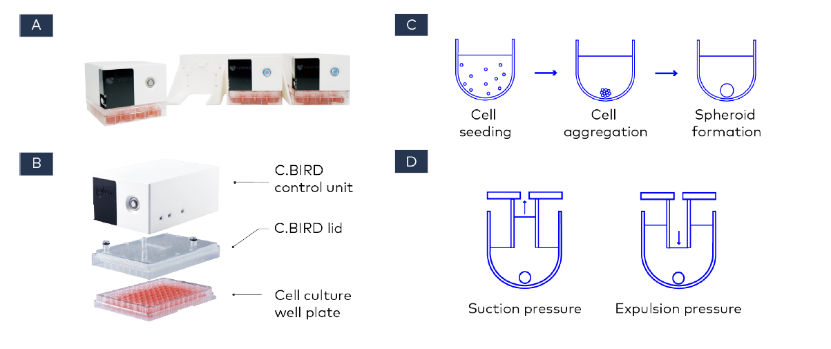
图2 比较在 96 孔超低附着板中静态培养和 C.BIRD 培养条件下结肠癌 HCT116 球体的生长情况和细胞健康状况。(A)在显微镜下观察 HCT116 肿瘤细胞系从第 3 天到第 10 天形成的球体形态。比例尺 = 0.5 毫米。(B)在 10 天内评估球体的生长动力学、圆度和圆整度。使用 ImageJ 软件进行分析,数据代表每组六个重复样本的平均值 ± 标准误。(C 和 D)使用 PrestoBlue 细胞活力试剂评估球体细胞健康状况。在球体培养 6、7 和 10 天后,向每个孔中加入 20 微升 PrestoBlue 细胞活力试剂,然后在 37°C 和 5% CO2 条件下再孵育 3 小时,之后在基于荧光的微孔板读数仪(激发/发射波长约为 560/590 纳米)上读取。细胞活力通过每个组的六个重复样本的荧光信号来测量。荧光信号通过球体直径进行标准化;较高的比率(荧光/直径)表明球体更健康。P 值的显著性列为:P ≤ 0.01(**),P ≤ 0.001(***)和 P ≤ 0.0001(****)。数据以平均值 ± 标准误表示。
由 500 个细胞形成的球体在第 3 天的直径约为 0.35 毫米,比静态培养组和 C.BIRD 培养组中由 1000 个细胞形成的球体要小(图 3A)。然而,第 6 天 C.BIRD_500 球体的直径、圆度和圆整度(0.7634 毫米)与 Static_1000 球体(0.7569 毫米)相似(图 3A 和 3B)。此外,第 6 天 C.BIRD_500 球体的细胞健康状况甚至优于 Static_1000 球体(图 3C 和 3D)。
通过使用 Calcein AM、NucBlue Live ReadyProbes 试剂和 DRAQ7 染色进一步评估了第 6 天球体的细胞活力。Calcein AM 和 NucBlue Live ReadyProbes 试剂(Hoechst 33342)用于标记活细胞。DRAQ7 是一种蒽醌化合物,可对死亡和通透性细胞的细胞核进行染色。
阳性对照中,球体用 4%多聚甲醛固定,作为死细胞。使用 Opera Phenix 高内涵筛选系统以共聚焦模式对球体的荧光进行成像(图 4A、4B 和 4C)。该图像是沿 Z 轴每隔 10 微米拍摄的 31 张图像的最大强度投影,拍摄范围为 300 微米,使用 10×物镜。对每个细胞的荧光进行测量并量化为平均强度。Calcein AM/NucBlue Live(活细胞)的平均荧光强度在静态培养和 C.BIRD 培养之间没有显著差异。即使 C.BIRD_1000 的球体大小也大于 Static_1000,C.BIRD_1000 组中 DRAQ7(死细胞)的平均强度也没有显著升高(图 4D)。这些结果表明,即使在较低的细胞接种密度下,C.BIRD 培养方法生成的球体在质量和数量上也与静态培养相似。
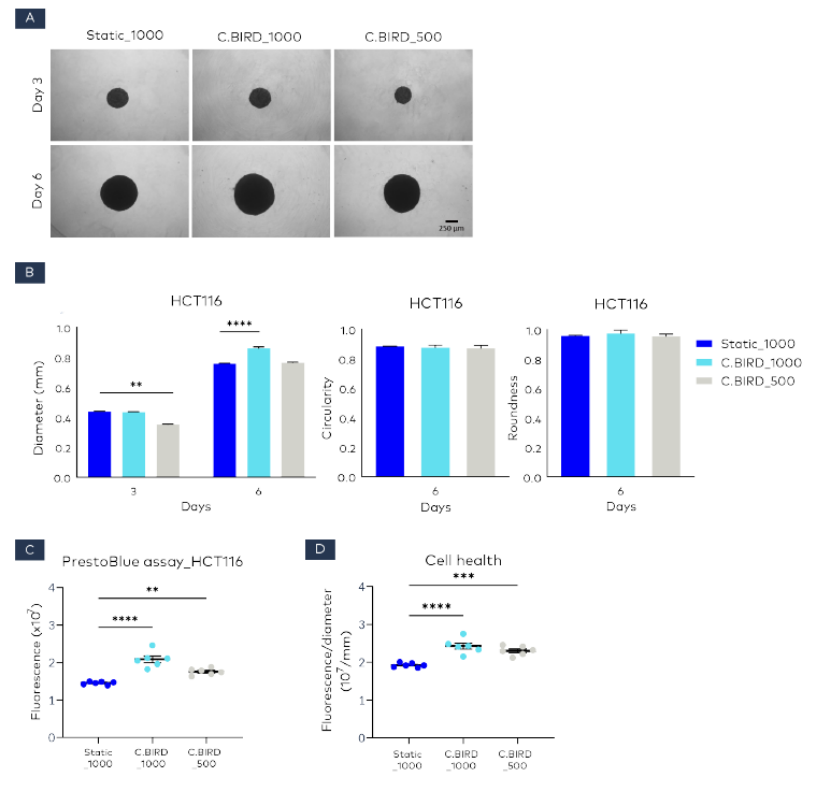
图 3 通过不同的细胞接种密度评估球体形态和细胞健康状况:静态培养中每孔 1000 个细胞(Static_1000);C.BIRD 培养中每孔 1000 个细胞(C.BIRD_1000)以及 C.BIRD 培养中每孔 500 个细胞(C.BIRD_500)。(A) 在第 3 天和第 6 天通过显微镜观察球体的细胞形态;比例尺 = 250 微米。(B) 在第 3 天和第 6 天测量球体生长动力学。在 6 天内评估球体的圆度和圆整度。使用 ImageJ 软件进行数据分析,并以每组六个重复实验的平均值 ± 标准误表示。(C 和 D) 在第 6 天使用 PrestoBlue 细胞活力试剂评估球体细胞健康状况。然后向每个孔中加入 20 微升 PrestoBlue 细胞活力试剂。随后将球体在 37°C 和 5% CO2 条件下孵育 3 小时,并在荧光微孔板读数仪上读取荧光值(激发/发射波长约为 560/590 纳米)。每组的活力通过六个重复样本的荧光信号来测量。荧光信号通过球体直径进行标准化;荧光与直径的比值越高,表明球体越健康。P 值的显著性标注如下:P ≤ 0.01(**),P ≤ 0.001(***)和 P ≤ 0.0001(****)。数据以平均值 ± 标准误的形式展示。
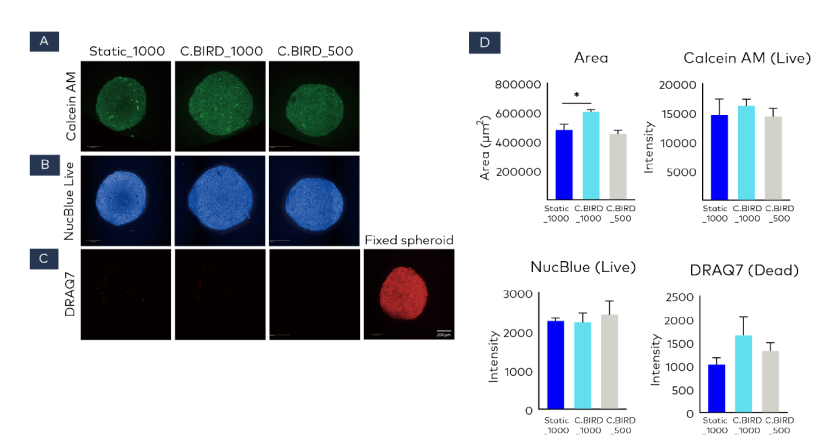
图 4 采用 Calcein AM 染料、NucBlue Live ReadyProbe 试剂和 DRAQ7 染料对球体细胞活力进行评估。球体培养 6 天后,将 Calcein AM 和 NucBlue Live ReadyProbe 试剂加入培养板,孵育 30 分钟,然后用半体积的杜尔贝科磷酸盐缓冲盐水(DPBS)冲洗至少三次。接着向培养板中加入 DRAQ7 染料,在 37°C 下孵育 10 分钟,再用 DPBS 冲洗,并使用 Opera Phenix 高内涵筛选系统进行成像。用 4%多聚甲醛固定的球体作为死细胞的阳性对照。(A-C)活细胞染色后在细胞质中发出绿色荧光(A),在细胞核中发出蓝色荧光(B)。死细胞染色后发出红色荧光(C)。比例尺 = 200 微米。(D)使用 Opera Phenix 高内涵筛选系统的软件对扫描区域和强度进行分析。数据以平均值 ± 标准误表示,每个实验重复三次。*P < 0.05 与 Static_1000 球体相比。
尽管在药物研发方面投入巨大,但新抗癌药物的获批率仍低于 5%。由于肿瘤的复杂性,三维培养肿瘤球体的技术被广泛用于研究药物活性,并已被证明比单层细胞培养更接近临床肿瘤的病理生理特征,且成本更低,动物实验更少。提高新药研发成功率的一种策略是利用肿瘤球体进行高通量药物筛选。优化球体培养对于生成高质量的球体以供医学领域使用至关重要。在我们的研究中,C.BIRD 培养的球体生长速度高于 ULA 板中静态培养的球体(图 2)。C.BIRD 培养的球体在第 6 天和第 7 天的细胞健康状况也优于静态培养的球体(图 2)。此外,在相同的接种密度下,C.BIRD 培养的球体在第 7 天的大小与静态培养的球体在第 9 天的大小大致相同(图 2),并且 C.BIRD 培养中的球体细胞健康状况优于静态培养中的球体细胞(图 3)。
总之,我们的研究结果有两个主要意义:(1)C.BIRD 培养方法通过使用 ULA 板在无血清培养基中改善了肿瘤球体的生长;(2)C.BIRD 混合培养延长了球体的存活时间。这意味着 C.BIRD 文化方法是优化肿瘤球体 3D 文化的一个更好的选择,并且能够改进药物筛选工作流程,从而在细胞活力/细胞毒性检测中获得更准确的结果。




