在生物制药和生物技术产业中,工程化哺乳动物细胞和微生物被广泛用于大规模生物反应器系统中生产蛋白质产品。溶解氧(DO)是细胞或微生物生长、维持和生产过程中的基本基质。在生物过程的规模放大阶段,氧传递系数(KLa)是寻找生物反应器最佳培养条件的关键参考因素。KLa参数控制着氧气从气相转移到液相的速率,并可能受到生物反应器多种因素的影响,如混合速率、气流速率、气泡大小、不同的液体或培养基等[1]。

CYTENA的S.NEST微型生物反应器和S.NEST盖子允许在标准细胞培养板的每个孔中吸排空气,实现每个孔内不同混合周期的连续往复混合(图1A)。因此,S.NEST微型生物反应器将悬浮培养和晚期条件引入到早期细胞系开发(CLD)流程中,提供了比96孔和24孔板静态培养更多的生长空间和氧气。目前已证明,S.NEST的微孔板混合培养系统可以显著增加氧气传递到水性介质中,为需氧培养提供比静态培养更好的培养环境[2]。因此,我们的混合培养提高了贴壁细胞系HEK293和悬浮细胞系CHO-S的细胞生长速度[3,4]。S.NEST微生物反应器的一个显著特点是,在整个细胞培养过程中,使用附着在每个孔底部的光学的DO和pH传感器实时监测DO和pH值(图1B)。在本篇应用中,我们使用S.NEST板内置的DO传感器演示了不同工作体积和混合速率下S.NEST微生物反应器中的KLa。

图1.(A)S.NEST 系统连续往复混合的原理,(B)每个S.NEST板孔底部附有光学传感器,用于监测DO和pH值
本研究中,所有实验均在S.NEST微型生物反应器中进行,使用1000 µL或1400 µL的DPBS在37℃下进行培养。测试的混合速率包括每个周期50、30、10、5和2秒。我们使用排氧法来确定KLa,该方法包括三个阶段:校准阶段、耗氧阶段和溶氧阶段(图2)。在校准阶段,将DPBS加入S.NEST 24孔板中,盖上S.NEST盖,在S.NEST中以10秒/循环的连续混合速率混合1小时,以确保DO饱和。然后将DO水平校准为100%。下一阶段为耗氧阶段,向S.NEST供气,使DO耗尽,直至DO浓度达到最低。最后一个阶段是溶氧阶段,用空气代替氮气供应。每隔60秒实时监测三个阶段的DO水平。用于确定KLa的时间过程如图2(红框)所示。
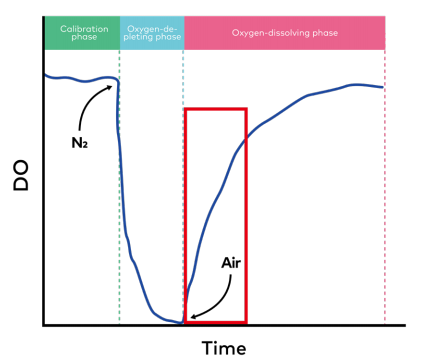
图2. KLa测定过程中DO的时间过程,红框表示用于确定KLa的DO的时间过程
1、混合速率是影响S.NEST中KLa的关键因素。在本研究中,我们测试了从2到50秒/周期的五个混合速率,结果表明,KLa随着混合速率的增加而增加(图3)。在使用1.0 mL的DPBS时,KLa在2秒/周期的混合速率下达到了最大值30.48 h-1。此外,工作体积也是影响S.NEST中KLa的另一个关键因素,增加工作体积对KLa有负面影响。在相同的混合速率下,1.0 mL工作体积的KLa比1.4 mL工作体积的KLa高出约15%。

图3. 不同混合速率下,加入1.0 mL和1.4 mL DPBS的S.NEST的KLa值,误差条代表标准偏差
2、基于本研究的KLa,我们分析了KLa与混合速率的相关性(图4)。KLa与混合速率-1成正比。因此,这些曲线可以作为选择所需混合速率的指导。如图5所示,Sartorius Ambr®15细胞培养系统(图5A)和5L生物反应器(图5B)在不同条件下的KLa值[5,6]。
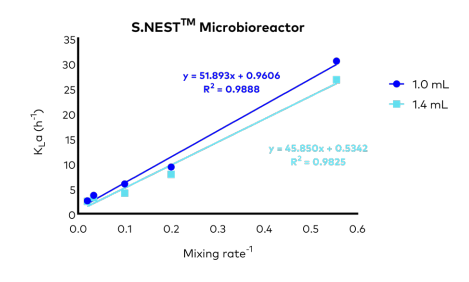
图4. S.NEST微生物反应器中KLa与混合速率的关系

图5. (A)Ambr15细胞培养系统与(B)5L搅拌式生物反应器在指定条件下的KLa值
本技术说明展示了S.NEST微型生物反应器中KLa值是可调节的。通过调整液体积或混合速率可以获得不同的KLa值,从而确定需氧培养的最佳培养条件。S.NEST培养板中内置的DO传感器还可以使用户能够在所需条件下手动确定KLa值,以进一步进行过程转移和规模放大。
同腾睿杰(上海)生物科技有限公司作为 Cytena S.NEST 新一代微型生物反应器中国代理商,为您提供优质的售前售后服务。
联系电话:021-50826962
联系邮箱:sales@ttbiotech.com




