双特异性抗体 (bsAbs) 是一类工程binder,旨在同时靶向两个化学上不同的表位。这种独特的结合模式可用于诱导以前无法实现的作用机制,在肿瘤学、自身免疫性疾病、慢性炎症性疾病、出血性疾病甚至传染病的许多治疗应用方面具有巨大潜力。bsAbs 的结合特性对其功能至关重要,因为形成相互作用的倾向、相互作用的稳定性(半衰期)和平衡亲和力都会影响作用机制。对于两个分子之间的二元相互作用,结合可以用三个生物物理参数直接描述,即结合速率常数 kon、解离速率常数Koff以及平衡解离常数 Kd。对于双特异性binder,情况更为复杂,因为必须考虑两种不同的二元相互作用,从而产生三元相互作用(图 1)。此外,三元复合物可能会因其他协同因素而稳定或不稳定,例如三种结合剂的空间排列、构象灵活性或参与相互作用的分子部分的局部浓度。
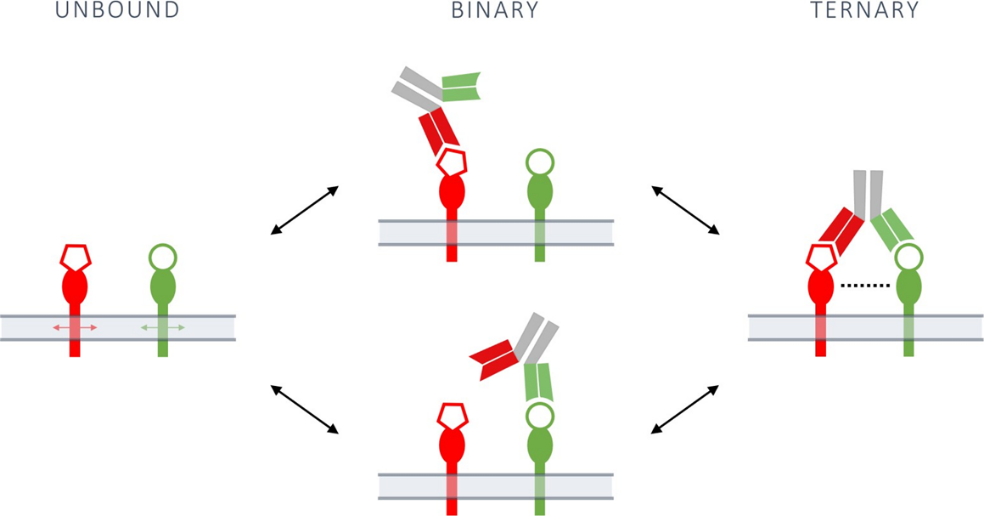
图1. 双特异性抗体与细胞表面两个靶标相互作用的二元和三元结合模式。
三元复合物的稳定性取决于所有可能的(不)结合情况的结合和解离动力学。由于多个参数相互依赖,单独测量二元结合动力学不足以预测三元复合物的行为。传统的分子互作分析方法并不适用于表征涉及 bsAbs 的三元复合物。例如SPR)测量得出的结合值与 ELISA 测定和生物活性存在显著偏差。这可能是因为 SPR 或类似的传感器无法区分 bsAb 是否与传感器表面的一个或两个目标结合,因为折射率传感只能检测到传感器上分析物分子的存在,但无法识别相互作用过程中建立了多少个键。此外,当在葡聚糖修饰表面使用常规共价固定策略时,很难以明确的化学计量将一种以上的抗原固定在表面上。最关键的限制是此类夹心法检测不能反映两种抗原同时在同一细胞表面呈递给 bsAb 的情况,这会导致抗体结合行为产生avidity。以 emicizumab(商品名Hemlibra®) 为例,avidity实际上是 FX 激活过程中天然血小板表面所需的结合模式,是产生生物活性的先决条件(图2)。
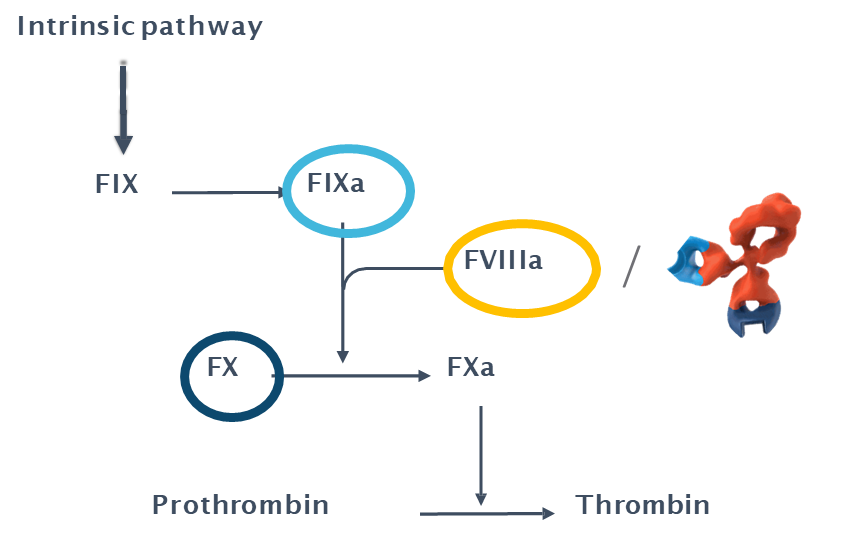
图2. FIX、FX与FVIIIa形成三元复合物催化凝血酶形成示意图。
为了描述双特异性治疗性抗体 emicizumab 的二元和三元结合特性。我们设计(见图3)并使用了一种灵活的Y形DNA纳米结构将抗原固定在传感器上,使两个靶标都可被溶质bsAb结合。使用双色荧光检测,我们可以实时跟踪emicizumab 的各个互补位与其各自靶标 FIX 和 FX 的结合情况(图4)。
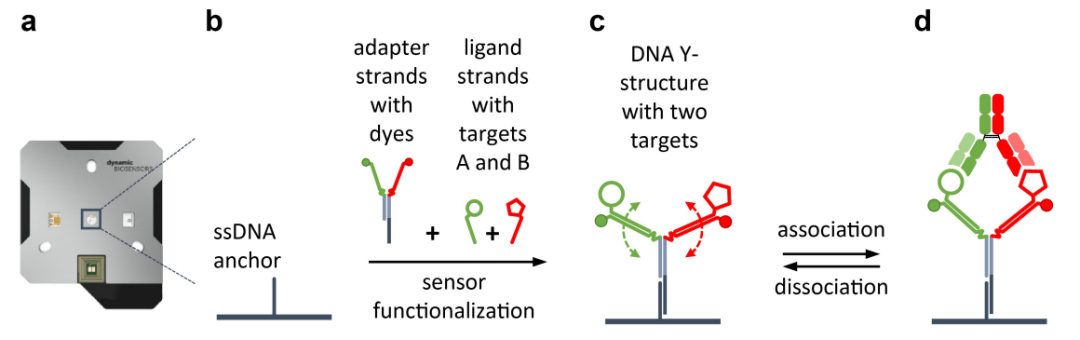
图3. 芯片及Y结构设计原理示意图。(a) 带有微流体通道的 heliX® 生物芯片,该通道具有两个检测spot;(b) 单链锚定寡脱氧核苷酸共价连接到芯片的金表面,以便进一步与 DNA 功能化;DNA Y 结构由两条适配链组成,这些适配链用绿色和红色染料修饰以进行荧光检测(实心圆),两条配体链与相应的靶标(FIX = 空心圆,FX = 空心五边形)结合;预成型的 Y 结构通过将其碱基杂交到芯片表面的“锚”链上而固定 (c) 用 DNA Y 结构功能化的芯片表面,具有两个柔性臂,用于在不同距离处显示抗原。;(d) Emicizumab 与 FIX 和 FX 靶标结合。测量靠近各个靶标的绿色和红色染料的荧光变化,以分别分析抗体臂与 FIX 和 FX 的结合。
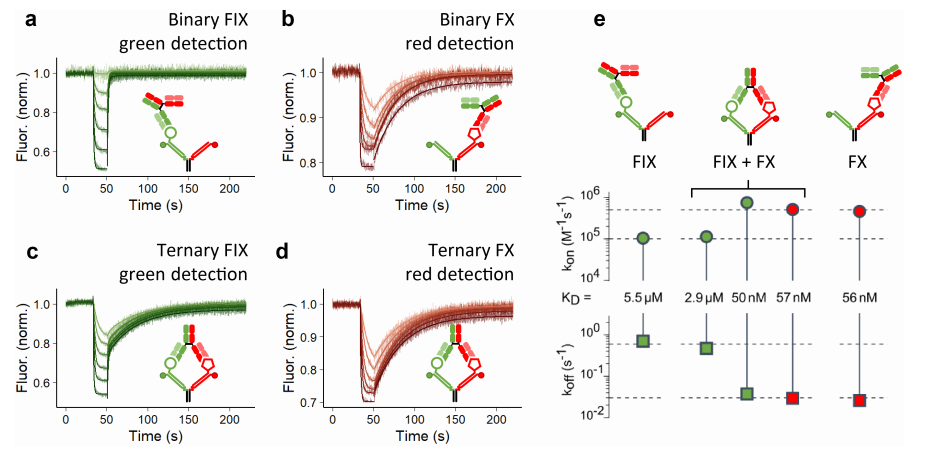
图4. 实时测量 Emicizumab 与固定在 DNA Y 型结构上的 FIX 和 FX 的结合和解离。bsAb emicizumab 的浓度为 0.0512、0.128、0.32、0.8、2、5 µM。(a) 二元 FIX – emicizumab 相互作用在仅用 FIX(无 FX)修饰的 Y 型结构上测量,信号检测为绿色。(b) 二元 FX – Emicizumab 相互作用在仅用 FX(无 FIX)修饰的 Y 型结构上测量,信号检测为红色。(c) 和 (d) 三元相互作用在用 FIX 和 FX 修饰的 Y 型结构上测量。信号同时以绿色 (C) 和红色 (D) 测量。(e) 分析的结合(顶部)和解离(底部)速率常数的速率尺度图,以及解离常数 KD(中间)。二元相互作用 (a、b) 和三元 FX 相互作用 (D) 用单指数拟合函数分析,FIX 臂上的三元相互作用 (C) 用双指数拟合函数分析。拟合线在测量数据上绘制为平滑线,采样时间为 200ms。
对 bsAb emicizumab 的二元和三元结合动力学的测量产生了三个重要发现。首先,bsAb 与其两个靶标的两种二元相互作用明显不同,emicizumab 与 FX 的结合速度比 FIX 快 5 倍、稳定 20 倍,总体上强 100 倍。其次,三元结合明显不同于二元结合,并表现出双相解离特性。第三,三元结合的发生程度取决于结合阶段 bsAb 的浓度。这些结果表明了以下解释,该解释以图形方式总结在图 5 中。如图 5(a) 所示,三元复合物的形成发生在低 bsAb 浓度下。在第一步中,当 emicizumab 遇到 Y 结构呈现的两个靶标时,它最好先与 FX 结合,因为结合速率比 FIX 高 5 倍。在第二步中,emicizumab 的另一条臂与 FIX 结合,后者通过 Y 型结构呈现在 emicizumab 的触及范围内。由于 FX 结合的 emicizumab 已经接近 FIX,因此这种交接发生得很快(与 FX 结合相比),这就是为什么在 FIX 的绿色信号中也观察到了类似 FX 的结合率。当然,emicizumab 与 FIX 或 FX 之间发生二元相互作用而不形成三元复合物也是可能的,也可能通过较弱的相互作用 FIX 捕获形成三元复合物,但这些过程发生的可能性要小得多。随后三元复合物开始衰变。一旦两个靶标都参与其中,三元和二元状态之间就会发生动态转变。然而,由于 FIX 的结合力要弱得多,在整个复合物最终完全解离之前,很可能是 FIX 而不是 FX 被其 Fab 释放并反弹了好几次或很多次。因此,虽然涉及较弱结合剂 FIX 的相互作用会因强结合剂 FX 的存在而增强,但 FX 相互作用却几乎不受弱相互作用剂 FIX 存在的影响,因为它太弱,无法显著改变 FX 的动力学。因此,在二元和三元情况下观察到的 FX 动力学相似。
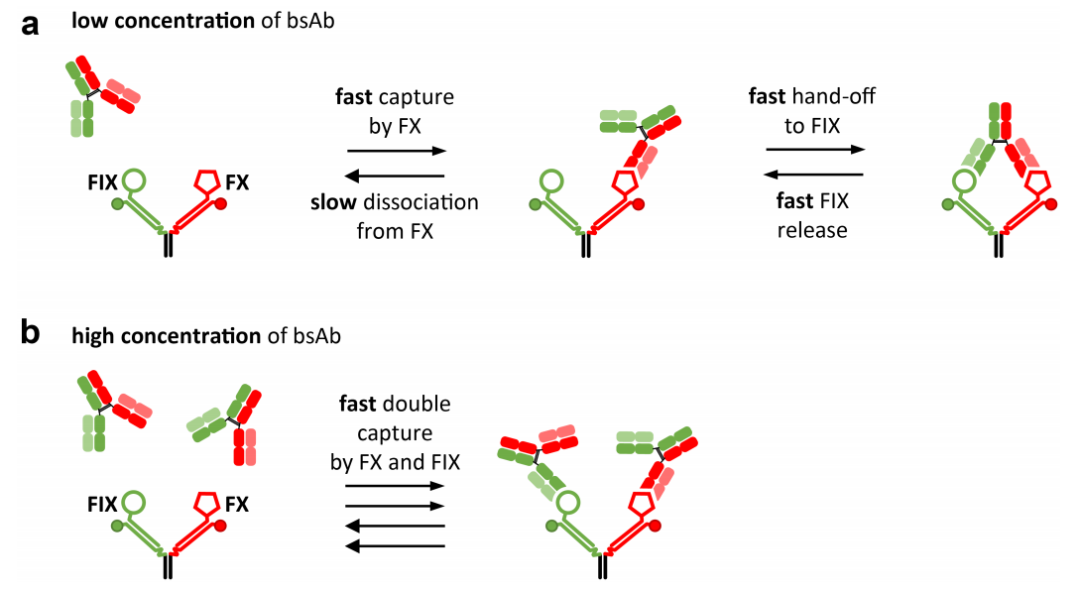
图 5. 低 (a) 和高 (b) 浓度的 emicizumab 的主要结合模式示意图。 (A) 在低浓度下,与 FX 的更快结合会捕获抗体并允许快速移交给 FIX,从而形成三元复合物。(B) 在高浓度下,亲和力较低的 FIX 也会快速结合抗体,从而在一个 Y 型结构上产生两个二元相互作用。(A) 和 (B) 的组合可观察为浓度依赖性双指数解离曲线。
如图 5(b) 所示,在高 bsAb 浓度下,三元复合物的形成受到抑制。在微摩尔浓度的 bsAb 下,溶液中的 bsAb 结合与 FX 促进的捕获和交接机制竞争。预计当溶液中的抗 FIX Fabs 浓度超过 Y 结构上的局部浓度时会发生这种情况,该浓度已确定在 0.1–0.2 µM 范围内。因此,当溶液中的 bsAb 浓度远高于 0.1 µM 时,二元结合模式下的双重捕获更受青睐。在较高分析物浓度下形成的三元复合物较少,这一发现让人想起高剂量“hook”效应,这是免疫测定中的常见干扰。通常,在结合过程中,抗体的一条臂与一个靶标结合,然后第二条臂与第二个靶标结合,形成三元复合物。在高分析物浓度下,两种抗体同时与一个靶标对结合的可能性更大,从而阻止三元复合物的形成。了解这些结合特性使我们能够了解 emicizumab 在体内的作用方式。在血浆中,FIX 和 FX 的浓度分别为 90 和 135 nM。尽管预计 Emicizumab 会与溶液中的两种凝血因子频繁相互作用,但模拟表明,只有极小部分的 Emicizumab 在血浆中形成三元复合物。这是因为,如果其相互作用没有通过 FX 介导的表面亲和力稳定,它会快速与 FIX 解离。只有当 FIX 和 FX 在损伤后与活化的血小板结合时,才能与 Emicizumab 建立三元复合物。

heliX+分子互作分析系统采用switchSENSE®技术,通过共价偶联或标签捕获方式将感兴趣的分 子(配体)固定在heliX®芯片上,结合标准的自动化 工作流程为分子互作提供高效解决方案。
同腾睿杰(上海)生物科技有限公司作为Dynamic Biosensors中国总代理商,为您提供优质的售前售后服务。
联系电话:021-50826962
联系邮箱:sales@ttbiotech.com




