双特异性抗体Emicizumab是血友病治疗的创新性研究成果
血友病是一类X-连锁遗传性疾病,由于体内缺乏凝血因子VIII或IX导致,因此其疾病类型在临床诊断中,目前分为两大类:一类是由于VIII缺乏所致,占血友病比例约为80%,称为A型;一类是由于IX缺乏所致,称为B型。最初主要治疗方法是选用重组凝血因子替代疗法或输注含有凝血因子的新鲜冰冻血浆等,主要的并发症是产生抗VIII或IX的抑制性IgG抗体,限制了替代疗法在疾病治疗中的适用性。
Emicizumab是一种人源化的IgG4型双特异性单克隆抗体,可以结合凝血因子IXa和X,桥连激活IXa和X,恢复凝血因子VIII的功能,发挥促凝血作用。双特异性抗体可以与细胞膜表面的两个不同的靶点结合,增强了抗体的靶向性和特异性,同时可以在生理性膜上诱导两个不同的抗原在空间上相互靠近,从而发挥下游信号通路中的激活或抑制作用;更为关键的是,Emicizumab与FVIII不存在序列同源性,因此不会诱导或增强FVIII抑制物的产生。对广大A型血友病患者来说,无疑是一种兼具创新性和可靠性的预防和治疗措施。
双特异性抗体抗与抗原结合的动力学研究具有来自传统技术上的挑战性
双特异性抗体概念的提出已经具有五十年之久,近二十年,对双特异性抗体的认识和研究才进入较快的发展阶段。相比较单靶向抗体,双克隆抗体具有多种多样的作用机制,更多的结构序列上的突变和双抗原结合分子动力学模式。其中,抗体与抗原的结合动力学研究,对于双特性抗体的功能研究是至关重要的一部分。分子间相互作用形成的能力,相互作用的稳定性以及亲和性,都将会影响分子之间互作后功能的发挥。对于两分子之间的二元结合,上述参数的测量相对比较简单,我们通常使用结合常数(Kon),解离常数(Koff)以及结合和解离的平衡常数((Kd))对分子之间的结合动力学行为进行表征。
对于二元复合物的生物学检测方法多种多样,主要包括表面等离子共振技术(SPR),生物膜干涉技术(BLI)等;SPR在进行二元复合物分子结合动力学研究中,首先需要将抗原分子固定在生物传感器表面,将含有抗体分子的流动相流经生物传感器,通过两分子结合前后光的共振角度的变化,对结合和解离进行实时的测量;BLI利用光纤生物传感器实时检测分子之间的相互结合动力学,通过分子结合前后生物膜厚度变化导致的干涉波波长的移位,进行参数的定性;但是双特异性抗体与靶抗原的结合,将主要以三元复合物的形式存在,其动力学行为,尤其是解离过程的动力学行为较二元复合物,变得更为复杂。以上传统的技术都以单参数进行表征,无法对复杂的三元结合进行精确的动力学测量。
三元复合物中包含两个二元复合物,且这两个二元复合物之间存在相互作用和相互影响,改变了其单独做为二元复合物时的动力学行为;同时,三元复合物中的三个分子,其结构,化学性质等都存在较大的差异,因此环境状态的改变,比如分子浓度,分子的空间排列等,都会对分子之间结合的稳定性产生更为突出的影响;对于分子之间的解离,二元复合物的单向解离,比如抗体的单臂解离,代表了整体相互作用的分离,但对于三元复合物来说,单臂解离后,会因为两臂的不同亲和能力产生的滞留效应,会再次发生结合作用。Figure 1代表了不同的结合模式示意图:
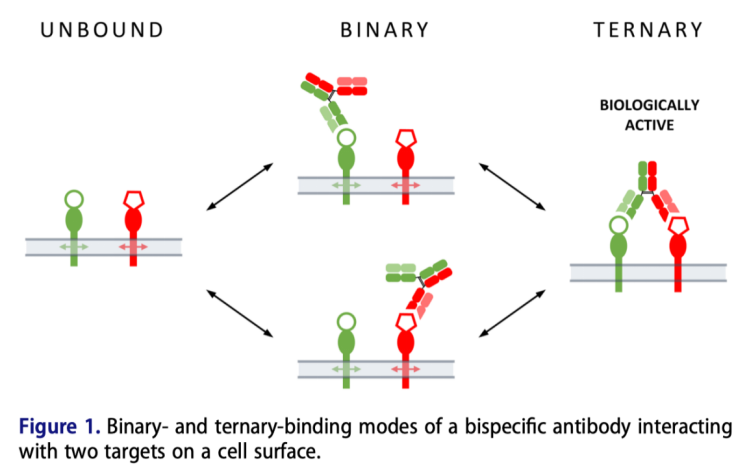
Figure 1代表了不同的结合模式示意
无论是SPR,还是BLI,在进行三元复合物测量时,其无法测量底物分子与表面分子结合的性质,化学计量比,不能够区分复杂的解离状态和判断解离信号的来源,因此也无法测量三元复合物形成后的分子动力学亲和性(Avidity)。但对于双特异性抗体的早期研究来说,(1)抗体是否具有结合双靶向分子的能力;(2)该双靶向分子是否存在于同一细胞表面,在空间距离上是否能够进行控制;(3)在化学计量比上是否可以模拟细胞膜表面状态,对于其后期的优化和开发无疑是至关重要的。
新一代SwitchSence是解决三元复合物实时动力学研究的突破性技术
SwitchSence是基于流体动力学和生物传感器芯片发展起来的一门应用性技术。其主要结构包括(1)含有DNA纳米杆的芯片;(2)红色与绿色两种不同的荧光分子;(3)流体动力系统;其原理是将带有荧光素的DNA分子和带有配体的DNA分子进行碱基互补配对,进而实现DNA分子的杂交;杂交后的双链DNA分子中的部分单链片段与芯片上存在的DNA锚定链进行再次杂交,形成具有携带配体与荧光素的功能化芯片。当在流体系统中的底物分子流经芯片表面时,发生分子之间的相互作用,荧光素分子释放荧光,发生荧光信号的改变,以此表征分子结合的动力学参数。
根据荧光信号改变的不同原理,我们可以在芯片表面进行不同的检测模式的设计。对于双特异性抗体来说,我们采用的是 “Y” 型结构的DNA纳米杆,其原理示意图如Figure 2所示:
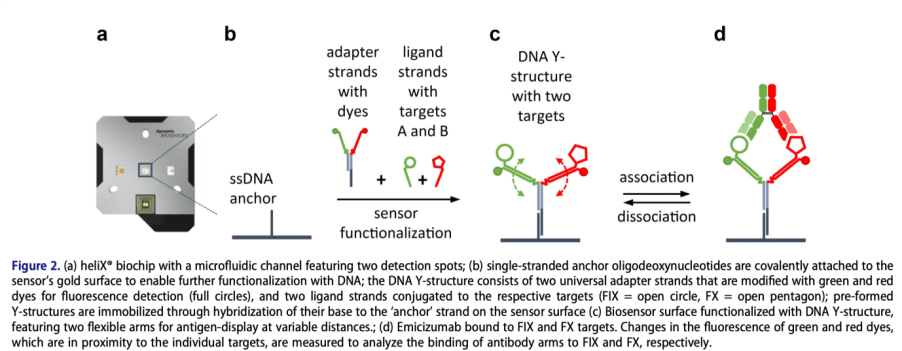
该 “Y” 型结构的两个臂中,两条适配链分别带有红色和绿色两种荧光,两条配体链分别携带有待检测的两种抗原。在Emicizumab的流体动力学研究中,分别是凝血因子FIX和FX。该设计突破了单个参数进行三元复合物检测的局限,采用双色荧光分别对每一个二元复合物进行检测,同时,利用荧光分子与环境互作的敏感性光学原理,检测三元复合物形成的状态。

如Figure 3所示,在Emicizumab与抗原结合的动力学研究设计中,一组设计为两条配体链分别携带两种待检测抗原(Figure c和d),一组设计为配体链携带其中一种抗原,其中的另外一条配体链不与配体进行结合(Figure a和b)。其中绿色荧光端配体链结合的是凝血因子FIX,红色荧光端配体链结合的是FX。在进行三元复合物检测时,当底物分子(Emicizumab)与FIX和FX结合形成三元复合物时,绿色和红色两种荧光分子由于配体(抗体)的结合,其存在的环境发生改变,两种荧光分子与环境的互作导致其发生荧光的淬灭。
与二元复合物的结合动力学相比,可以看出,FIX的存在,对FX与抗体结合的亲和性具有明显的影响(Figure 3)。该技术不仅可以直观的反馈双抗原彼此之间的相互影响,通过解离曲线,我们也可以观测到,在三元复合物的解离过程中,存在双相的解离形式,表现为该抗体与抗原的解离存在快和慢两种解离过程。
在双特异性抗体的研发中,对药物与靶分子的解离速度的要求或亲和性的需求,根据药物实现的功能不同而有所差异。为了更进一步阐明双特异性抗体的浓度变化如何影响三元复合物的不同解离过程,我们采用了浓度梯度检测。
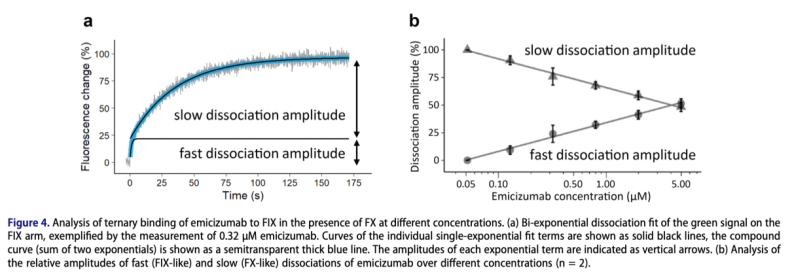
如Figure 4所示,随着Emicizumab浓度的增加,慢解离过程所占的比例逐渐增加。这说明,浓度提高,FIX与抗体结合的动力学影响程度提高;而在低浓度时,FX与抗体结合的动力学影响程度提高。这对于指导后续临床类药物的开发具有极大的意义。而传统的二元复合物检测技术,无法实现该参数的测量与数据的拟合。
Switchsense是基于生物芯片发展起来的一门技术,由位于德国慕尼黑DBS(Dynamic Biosensor)公司研发,其仪器称为Helix Plus多模式分子互作仪器,目前该公司已被布鲁克(BRUKER)收购,HelixPlus也将成为其分子互作领域的重磅产品。仪器外观如图所示:

该仪器可以进行多种类型的分子互作检测,包括二元互作,比如蛋白和蛋白,蛋白和核酸,小分子和蛋白等;三元复合物检测,比如文中提到的双特异性抗体(Bispecific Antibody)以及PROTAC分子等;除互作之外,该仪器可以检测小分子或核酸等诱导的蛋白构象的变化,对于当今的药物研发领域来说,无疑是具有重要意义的检测手段。
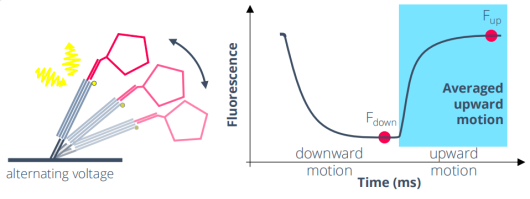
蛋白构象变化检测原理图




