DNA链间交联是DNA损伤的一种重要表现形式,交联的存在,抑制了DNA正常的复制和转录功能,因此可以诱发肿瘤等多种严重性疾病的发生。交联损伤一旦发生,将激活生命体内的修复机制,对损伤部位进行修复,进而保障了生命体正常的生理功能。在正常的生理应激反应下,当交联发生后,ATR激酶将磷酸化FANCI蛋白,从而促进Fanconi anemia (FA) 复合物对FANCD2-FANCI异源二聚体中的FANCD2蛋白进行泛素化。泛素化的发生可以介导二聚物与DNA的结合,并招募核酸酶等DNA修复的关键蛋白,以实现DNA修复功能。本文旨在探讨,FANCI蛋白的磷酸化是通过何种机制促进DNA修复的进程,并发掘不同的转录后修饰行为之间如何相互影响,实现DNA修复过程。
已有的报道认为FANCD2-FANCI异源二聚体(简称D2-I)是一种与DNA结合的发夹型复合物,未发生翻译后修饰的D2-I复合物,在结构上呈现一种“打开”的状态;在该种结构模式下,两个蛋白相应的赖氨酸泛素化位点位于蛋白相互作用的界面,在结构上处于一种未暴露的状态。异源二聚物和DNA的结合以及与FA核心复合物成分的相互作用,改变了D2-I的结构状态,使得关键的赖氨酸残基暴露在环境中,促进了它们泛素化的发生。但在体外,双链DNA(dsDNA)在促进D2-I的泛素化和与DNA之间后续结合方面并非是必须的因素。那么,D2-I泛素化的激活以及后续与DNA的紧密结合,产生修复功能,其中关键的诱发因素是什么呢?
我们已经知道,DNA损伤修复激酶ATR可以激活FA信号通路,FANCI蛋白序列中的三个关键氨基酸残基的磷酸化,可以促进D2-I的单泛素化,并促进其与DNA的结合;同时,磷酸化的发生也能够抑制复合物的去泛素化,进一步加强了该信号通路的功能性。相应地,在细胞中,ATR激酶的失活,将导致细胞对DNA交联剂更加敏感以及在FA复合物介导的DNA损伤修复方面的缺陷。已有的研究已经证实FANCI的磷酸化可以增加复合物与DNA结合的时间,进而促进复合物的泛素化。但是,这种促进作用是以何种机制起作用,比如从结构的层面,从结合亲和性等方面,目前并不清楚。
本文通过模拟FANCI生理状态下的磷酸化(简称D2-I 3D),探讨了ATR激活FA通路的结构和分子机制。电镜结构显示,在没有发生泛素化的情况下,D2-I 3D的发夹结构在DNA上依然呈现更加紧凑的状态,这说明泛素化的发生并不是促进复合物与DNA紧密结合的关键因素,磷酸化可以改变复合物结构的“打开”状态,向更加紧凑的状态转变,这种状态的转变可以促进FA对蛋白的泛素化作用。
本文对上述结论,从以下四个方面进行论证。
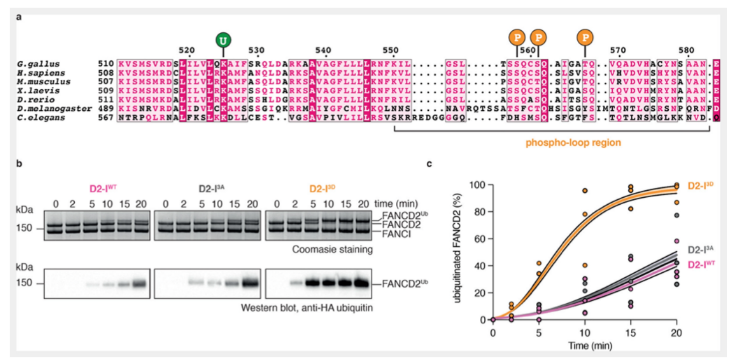
在缺乏ATR激酶的情况下,模拟的磷酸化的蛋白FANCI仍旧可以促进FANCD2的泛素化,这说明ATR激酶通路实质上是通过促进FANCI的磷酸化激活FA信号通路,促进FANCD2的泛素化发生。那么磷酸化是如何影响泛素化发生的呢?为了回答这个问题,本文纯化了三种蛋白:模拟的来源于鸡的FANCI磷酸化蛋白(简称D2-I 3D),在该蛋白中,三个保守的磷酸化位点,丝氨酸558,丝氨酸561和苏氨酸567,被突变成天冬氨酸;野生型的FANCI蛋白(D2-I WT)和失去被磷酸化功能的FANCI蛋白(D2-I 3A),在该蛋白中,上述三个保守位点被突变成丙氨酸。
这三种蛋白对于FANCD2的泛素化分别有什么影响呢?本文进行了体外的泛素化检测,在44bp的dsDNA和重组的FA核心蛋白复合物存在的情况下,WT和I-3A对FANCD2的泛素化影响是相一致的,在20分钟内,约40%的FANCD2发生了泛素化;而I-3D的泛素化效率明显提高,在10分钟后,约75%的FANCD2蛋白发生了泛素化,20分钟后,大于95%的FANCD2发生了泛素化。这些结果说明,FANCI的磷酸化可以促进FA对FANCD2的泛素化作用。
ATR的磷酸化位点位于FANCI的灵活可变区域,与FANCI的泛素化位点,FA核心复合物成分,Ube2T及USP1-UAF1结合位点相邻,报道将其称为“磷酸环”。在非泛素化的鼠的D2-I晶体结构中,磷酸环位于FANCD2和FANCI蛋白互作界面,处于一个氢键构成的网络之中;但并没有相关的电镜结构数据,说明磷酸环的内部是灵活可变的,并不容易进行相关的结构解析。
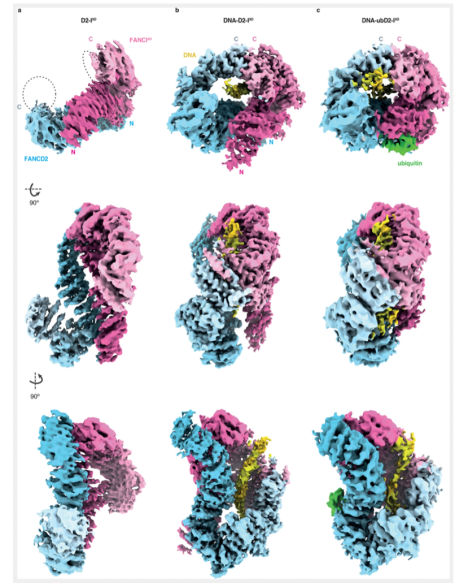
为了从结构的角度分析FANCI的磷酸化是如何促进FANCD2泛素化的发生,本文对D2-I 3D,D2-I3D和DNA,泛素化的D2-I 3D和DNA进行了电镜结构解析,其分辨率分别是4.1,3.5和4.4Å. D2-I 3D在没有DNA存在的情况下,在结构上呈现的是更加“打开”的状态,这说明磷酸化本身并不能改变蛋白复合物的结构状态,但是在DNA存在的情况下,泛素化的D2-I 3D与DNA结合上呈现的是更加紧凑的状态。那么是泛素化的发生,还是DNA存在的本身,对D2-I 3D的结构产生了影响呢?影响的意义是什么呢?在DNA存在的情况下,D2-I 3D与DNA的结合呈现了紧凑的状态,这与之前的研究结果相悖,已有的报道发现非泛素化的DNA-D2-I结合复合物中,D2-I呈现的是“打开”的状态,紧凑的结构状态是由于泛素化得到发生而引起的。
本文构建了一个DNA-D2-I 3D复合物模型,并将其与已报道的D2-I的结构进行比较。除了FANCD2的可变的N端区域,D2-I 3D的紧凑状态并不影响单个亚基的总体结构状态。为了实现与DNA结合的紧凑状态,FANCD2和FANCI 3D会绕着它们N端形成的铰链进行旋转,使得它们的蛋白C端可以接近,进而发生互作,并与DNA形成一个新的相互作用界面。结合上述的数据结果表明,FANCI的磷酸化在DNA存在的情况下,可以促进D2-I复合物与DNA结合的紧凑性,DNA在其中的作用,可能充当一个旋转轴心的作用,或是类似于支架的作用;如果没有DNA的存在,这种旋转并不会发生,新的互作界面也不会发生。
那么这种紧凑的结构状态的发生的意义是什么呢?由于结构的改变,使得FANCD2和FANCI隐藏的泛素化位点暴露,FA核心复合物复合体成分可以与其发生作用。
以上结构数据表明,磷酸化通过以下机制促进了D2-I的泛素化:磷酸化的蛋白复合物,在dsDNA存在的情况下,发生结构上状态的变化,从“打开”的状态转变为“紧凑”的状态,这种转变,暴露了关键的泛素化位点Lys563。
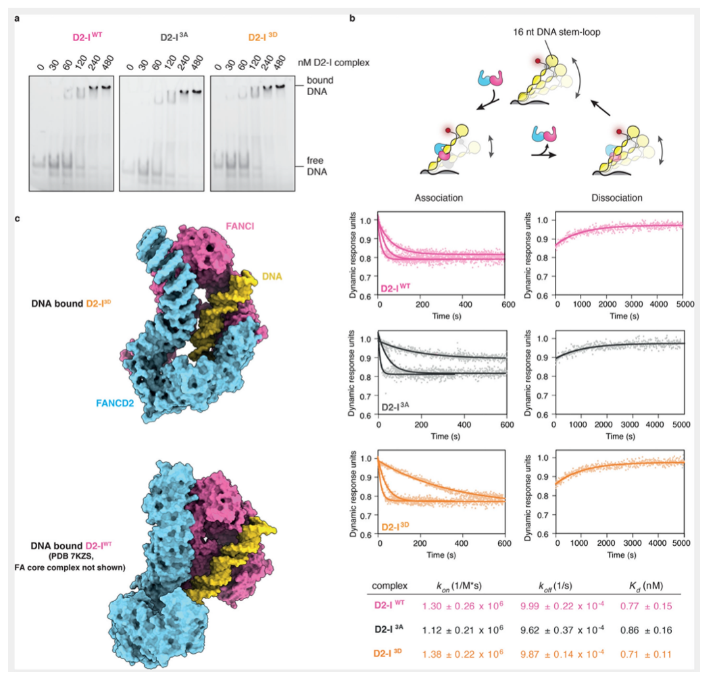
除了结构上的改变,促进了泛素化的发生,那么FANCI的磷酸化是否影响了复合物与DNA结合的动力学,比如降低解离率,延长复合物与DNA互作的时间等。已有的研究发现,模拟的FANCI磷酸化突变通过增加复合物与DNA结合的亲和性,促进FANCD2的泛素化。为了进一步验证D2-I 3D和野生型复合物D2-I与DNA结合的亲和性差异,我们通过凝胶迁移滞后实验(EMSA)检测D2-I WT,D2-I 3A和D2-I 3D与DNA结合的亲和性。但是,本文并没有检测到明显的差异。
本文考虑到EMSA技术受限于分辨率,对细微的差异无法进行检测。例如,比较慢的结合/解离与较快的结合/较快的解离可能具有相似的亲和性。因此,我们采用了SwitchSENCE技术对上述复合物进行了实时动力学检测。SwitchSENCE采用荧光标记的DNA纳米杆,纳米杆固定在芯片表面,并处于可变的电场之中。当待结合的蛋白经微流控液流流经芯片表面时,DNA和蛋白结合的实时动力学可以通过检测DNA纳米杆在电场中的荧光改变速度进行测量。由于双链DNA纳米杆一端固定在芯片上,另一端设计成环状结构,因此可以避免蛋白复合物从DNA链上的滑落,导致数据产生的复杂性和不可控性。结果显示,三种不同的复合物在结合/解离动力学上不存在明显的差异。但相比较于EMSA,对于三种复合物,SwitchSENCE测得的亲和性更加高,这也可能是由于DNA存在形式的差异。
以上结果说明,复合物的磷酸化状态并不能明显改变其与DNA结合的动力学。
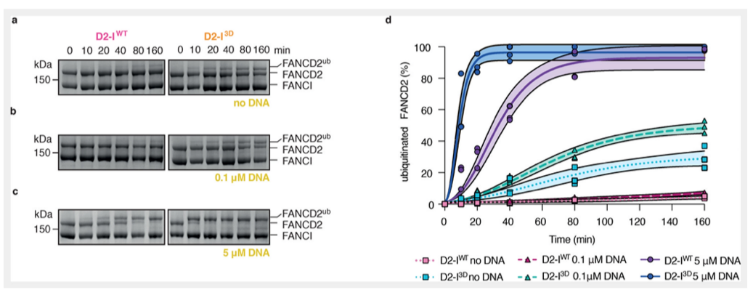
虽然已经验证复合物的磷酸化可以影响其开合状态,但是否与其泛素化的发生相关,并不清楚。本文认为D2-I的磷酸化主要是通过影响发夹结构的开合状态影响复合物的泛素化。为了检测FA核心复合物蛋白与D2-I WT和D2-I 3D结合的差异,我们在DNA缺失或在限制浓度下进行泛素化检测。首先,在DNA缺失的情况下,D2-I WT复合物并不能有效的发生泛素化,2小时反应,仅有大约5%发生了泛素化反应。但是D2-I 3D发生泛素化的速率是D2-I WT的10倍左右,即使在DNA缺失的情况下。所以,泛素化的发生依赖于磷酸化,但是否依赖于DNA呢?或则磷酸化本身是依赖于DNA存在的呢?有限的DNA的加入,促进了D2-I 3D的泛素化,但对D2-I WT并未产生影响。这说明,泛素化依赖于复合物的磷酸化,但DNA的存在可以极大的促进该泛素化过程。DNA是通过什么机制促进这一泛素化过程的呢?DNA在该过程中的作用是什么呢?本文推测是起到稳定复合物“紧凑”的状态。
为了更进一步从构象的角度探究D2-I WT和D2-I 3D的存在差异,我们通过定量交联质谱对溶液中的复合物状态进行分析。我们使用一种半衰期较短,UV-激活的异源双功能交联剂sulfosuccinimidyl 4,4’-azipentanoate (sulfo-SDA),在DNA存在与否的情况下,对D2-I WT和D2-I 3D复合物分别进行交联,可以获得短时状态下的分子内部互作状态。对于D2-I 3D复合物来说,DNA不存在时的交联模式和构象状态与两种复合物DNA存在时的差异比较一致,但与DNA不存在时,D2-I 3D的差异比较明显。这说明,磷酸化与DNA分子都是影响复合物构象状态的因素。那么磷酸化因素是如何影响复合物构象状态的呢?本文在DNA缺失的情况下,对D2-I WT和D2-I 3D分别进行了定量交联质谱分析。结果发现,两种复合物在DNA缺失的情况下,形成了相似的构象,但是特定的交联数量存在差异,说明在构象的状态上存在一定的差异。
通过更精细的数据分析,本文发现,在D2-I WT和D2-I 3D两种复合物的构象状态方面主要存在两种主要的差异。首先,不同的交联簇表明两种复合物的无序N端位置上的不同;在D2-I WT复合物中,FANCD2的N端与FANCI的patch交联,该位置位于D2-I复合物互作界面,并与磷酸环和FANCI-K525氨基酸相接近。这种交联的状态在D2-I 3D复合物中并不是主要的交联,相反,其与FANCI交联的区域与复合物互作界面相距较远。
以上数据进一步表明,磷酸化和DNA的结合对复合物D2-I具有相似的效应,改变其N端序列的交联状态,促进复合物转变为更为“紧凑”的状态。
其次,在泛素化位点附近,具有特定的交联模式。我们知道,在D2-I复合物的“打开”状态中,这些关键的泛素化位点未经暴露,在D2-I 3D复合物中,交联模式的改变,使得这些氨基酸残基发生暴露,使得FA复合物蛋白更易与其接近。
除了复合物N端的交联状态,本文也同时对C端的交联模式进行了分析。这种交联仅在DNA存在的情况下,复合物呈现更为”紧凑“的状态时发生。D2-I WT和D2-I 3D在DNA存在时,都可以围绕DNA形成“紧凑”状态,但在D2-I 3D复合物中,比起D2-I WT,C端交联高达3倍的富集程度。表明在D2-I 3D复合物中,“紧凑”状态的维持时间,长于D2-I WT。
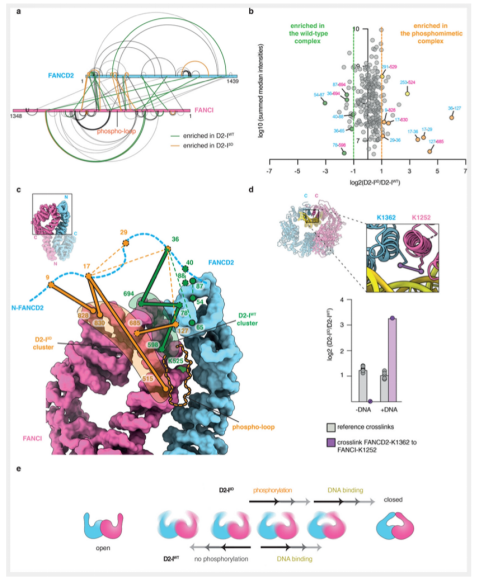
通过以上结果,本文证实,D2-I复合物存在“开”和“合”的构象动态平衡,无论DNA存在与否。与DNA结合导致的效应相似,磷酸化可以改变复合物的构象平衡,促进复合物从“打开”状态向“紧凑”状态的转变。

heliX+分子互作分析系统采用switchSENSE®技术,通过共价偶联或标签捕获方式将感兴趣的分 子(配体)固定在heliX®芯片上,结合标准的自动化 工作流程为分子互作提供高效解决方案。
同腾睿杰(上海)生物科技有限公司作为Dynamic Biosensors中国总代理商,为您提供优质的售前售后服务。
联系电话:021-50826962
联系邮箱:sales@ttbiotech.com




